CTD작성 경험은 대부분의 제약사에서 채용 시 요구하는 사항이다.
CTD가 무엇이기에 대부분의 제약사에서 작성경험을 요구하는지 알아보자.
CTD란?

국제의약품규제조화회의(ICH, International Council for Harmonization Technical Requirements for Pharmaceuticals for Human us)에 가입된 나라들이 각 나라마다 다른 의약품 허가양식을 하나로 통일화한 표준문서 양식이다.
많은 나라들이 하나로 통일된 표준문서를 사용함으로써 심사시간을 단축시키고 각 나라마다 달라 따로 작성해야 하는 양식을 없애 행정적인 불편함을 감소시키고자 하였다.
우리나라는 ICH에 정회원으로 2016년 11월에 가입하였으며, CTD양식을 국내 규정에 신약은 2009년 3월, 자료제출의약품은 2016년 3월부터 적용하고 있다.
우리나라도 CTD를 작성하고 있으니, 모든 제약사들이 CTD작성 경험을 요구할 수밖에 없다.
우리나라에서 의약품을 허가받으려면 CTD작성이 필수이기 때문이다.
CTD 구성
CTD는 아래와 같이 5부로 구성되어 있다.
1부 - 각 지역별 행정요구정보
2부 - 자료개요 및 요약
3부 - 품질평가자료
4부 - 비임상시험자료
5부 - 임상시험자료
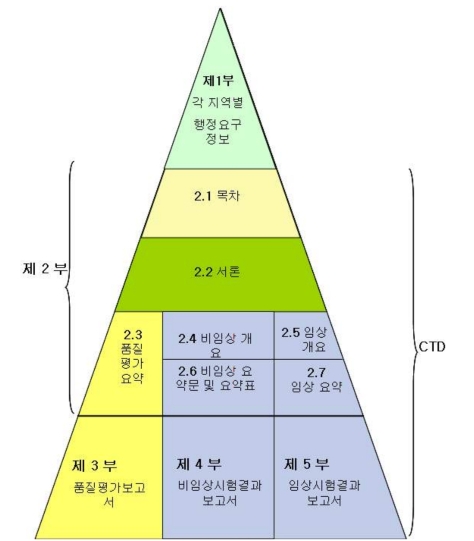
1부는 지역에 따라 조금씩 다를 수 있지만 2~5부는 같은 형식으로 한다.
우리나라에서는 2부는 작성 시에 한글로 작성하는 것을 원칙으로 한다.
3~5부는 원문이 영어로 기재된 것이면 영어로 된 것을 제출하는 것이 가능하다.
그럼 1부와 2부는 행정정보 및 요약이니 넘기고 3~5부는 어떤 내용이 들어가는지 알아보자.
3부 - 품질평가자료
품질평가자료 작성 시 들어가야 할 내용은 원료의약품인지 아니면 완제의약품인지에 따라 나뉜다.
원료의약품의 경우, 3.2.S Drug Substance 부분을 작성하여야 한다.
포함되는 내용은 원료의약품의 구조와 특성, 제조공정, 기준 및 시험법, 용기, 포장, 안정성 데이터 등에 대한 자료이다.
완제의약품의 경우, 3.2.P Drug Product 부분을 작성하여야 한다.
포함되는 내용은 완제의약품의 개요, 조성, 개발경위, 제조, 첨가제 관리, 기준 및 시험법, 밸리데이션 정보, 표준품 및 표준물질, 용기 및 포장, 안정성 데이터 등을 포함한다.
제약회사에서 요구하는 CTD 작성 경험이라 함은 CTD 3부 작성에 대한 경험일 확률이 높다.
제약회사 연구원이라면 CTD 3부를 작성하게 될 경우가 대부분이기 때문이다.
4부 - 비임상시험자료
4부에는 비임상시험 자료가 해당된다.
비임상자료는 in vitro, in vivo에서의 안전성과 유효성을 입증하기 위한 시험 결과들로 작성되어야 한다.
안정성 입증은 독성시험으로 하며 단회투여독성시험, 반복투여독성시험, 유전독성시험 등을 포함한다.
유효성 입증을 위해서는 세포나 질병동물모델을 대상으로 한 효력시험과 안정성약리시험, 약동학시험이 포함된다.
5부 - 임상시험자료
임상시험자료는 인간을 대상으로 한 유효성과 안전성 입증 자료를 요구한다.
흔히 임상시험에 대해 알듯이 1상 ~ 3상까지의 결과를 기입해야 한다.
이상 CTD가 무엇인지 어떻게 구성되어 있는지에 대해 알아보았다.
사실 제약회사에서 CTD작성의 경험을 요구하지만 신입의 경우 CTD작성 경험을 가지고 있기는 불가능하다.
경험은 없지만 CTD가 무엇이고 어떻게 구성되어 있는지에 대해 알고 있다면 충분히 제약회사에 어필이 가능할 것으로 본다.
그럼 여기서 포스팅을 마치겠다.
참고문헌: 「의약품_국제공통기술문서(CTD)_해설서」개정(안)
'정보공유 > 과학정보' 카테고리의 다른 글
| 노르말농도(N) (0) | 2024.12.29 |
|---|---|
| ⚡️ 전기영동(Electrophoresis) 원리와 방법 ⚡️ (0) | 2024.01.23 |
| [밀도시험법] 비중병을 이용한 측정법 (3) | 2024.01.11 |
| ppm(parts per million) 분석팀 필수 단위 (0) | 2024.01.05 |
| 🌟 히알루론산 필러🌟 모노페이직(Monophasic) vs 바이페이직(Biphasic) (1) | 2024.01.04 |




댓글